TEORIA GRACELI GERAL E UNIFICATÓRIA DIMENSIONAL.
- Gerar link
- X
- Outros aplicativos
TEORIA GRACELI GERAL E UNIFICATÓRIA DIMENSIONAL.
ONDE CADA INFINITA PARTÍCULA TEM INFINITAS DIMENSÕES FORMANDO UM SISTEMA GERAL UNIFICATÓRIO COM PADRÕES DE VARIAÇÕES CONFORME AS PARTÍCULA QUE NO CASO PASSAM A REPRESENTAR DIMENSÕES, PADRÕES DE ENERGIAS E E PADRÕES POTENCIAIS DE TRANSFORMAÇÕES, INTERAÇÕES CATEGORIAS FÍSICAS DE GRACELI E OUTROS.
NA TEORIA DAS CORDAS PARTÍCULAS SÃO REPRESNTADAS POR VIBRAÇÕES.
JÁ NA TEORIA GRACELI GERAL E UNIFICATÓRIA DIMENSIONAL. NO CASO SÃO REPRENTADOS POR DIMENSÕES FÍSICAS E QUÍMICA DE GRACELI.
TEORIA FÍSICA DE GRACELI GENERALIZADA ENTRE SDCTIE , TENSORES DE GRACELI, NO :
sistema indeterminístico Graceli ; SISTEMA GRACELI INFINITO-DIMENSIONAL
sistema indeterminístico Graceli ;
SISTEMA GRACELI INFINITO-DIMENSIONAL = sdctie graceli, sistema de infinitas dimensões +
SISTEMA DE TENSOR G+ GRACELI , ESTADOS FÍSICOS -QUÍMICO-FENOMÊNICO DE GRACELI CATEGORIAS E Configuração eletrônica dos elementos químicos
SISTEMA GRACELI INFINITO-DIMENSIONAL.
SISTEMA GRACELI INFINITO-DIMENSIONAL.
COM ELEMENTOS DO SISTEMA SDCTIE GRACELI, TENSOR G+ GRACELI CAMPOS E ENERGIA, E ENERGIA, E CONFIGURAÇÕES ELETRÔNICAS DOS ELEMENTOS QUÍMICO, E OUTRAS ESTRUTURAS.
ESTADO E NÚMERO QUÂNTICO, NÍVEIS DE ENERGIA DO ÁTOMO, FREQUÊNCIA. E OUTROS.
TENSOR G+ GRACELI, SDCTIE GRACELI, DENSIDADE DE CARGA E DISTRIBUIÇÃO ELETRÔNICA, NÍVEIS DE ENERGIA, NÚMERO E ESTADO QUÂNTICO. + POTENCIAL DE SALTO QUÂNTICO RELATIVO AOS ELEMENTOS QUÍMICO COM O SEU RESPECTIVO E ESPECÍFICO NÍVEL DE ENERGIA.
SISTEMA MULTIDIMENSIONAL GRACELI
ONDE A CONFIGURAÇÃO ELETRÔNICA TAMBÉM PASSA A SER DIMENSÕES FÍSICO-QUÍMICA DE GRACELI.
Configuração eletrônica dos elementos químicos. [parte do sistema Graceli infinito-dimensional].
Camada de valência
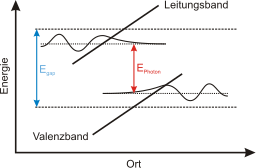
Camada de valência é a última camada a receber elétron no átomo ou o nível de maior número quântico principal e secundário na distribuição eletrônica. Normalmente os elétrons pertencentes à camada de valência são os que participam de alguma ligação química, pois são os mais externos. A contagem e distribuição dos elétrons é feita sempre de dentro (perto do núcleo) para fora.[1][2]
Por Exemplo : 


Cada uma destas camadas possuem um número máximo de elétrons. Assim, as camadas acima possuem, respectivamente 

Quando não há estabilidade, os átomos tendem a fazer ligações químicas com elementos que possam proporcionar os elétrons faltantes.
Os gases nobres possuem 

Como exemplo das ligações ocorridas em razão dos elétrons presentes na camada de valência, estão o Oxigênio, que possui 

Outro exemplo conhecido é o cloreto de sódio ou sal de cozinha. O Cloro possui 
A representação da tabela periódica permite que, através de uma breve análise, se conclua a respeito da quantidade de elétrons da última camada. Assim, os grupos 

Exemplos
- Ferro
tem número atômico igual a
[1]
- Distribuição eletrônica:
- Camada de valência: no último nível que é
com
elétrons
- Assim, o elemento Ferro
possui
elétrons em sua camada de valência.
Assim como o elemento:
- Prata
: número atômico igual a
- Distribuição eletrônica:
- Camada de valência: no último nível que é
com
elétrons
- Assim, o elemento Prata
possui
elétron em sua camada de valência.
Desta forma, é possível ligações iônicas ou covalentes, em diversos elementos e sua provável transformação em cátions e ânions.
Em resumo, a camada de valência sempre será a última camada da distribuição eletrônica.

O princípio de Aufbau (do alemão Aufbau, que significa "construção") ou princípio da estruturação, também conhecido como diagrama de distribuição eletrônica ou diagrama de Linus Pauling, é usado para determinar a configuração eletrônica de um átomo ou íon. O princípio postula um processo hipotético em que um átomo é "construído" pela adição progressiva de elétrons. Os elétrons preenchem os orbitais atômicos disponíveis dos níveis de energia mais baixos antes de ocuparem níveis mais altos.[1] Como eles são adicionados, eles assumem as condições mais estáveis (orbital atômico) com relação ao núcleo e aos elétrons que já estão lá.[2] Por exemplo, a camada 1s é preenchida antes que a subcamada 2s esteja ocupada. Desta forma, os elétrons de um átomo ou íon formam a configuração eletrônica mais estável possível. Um exemplo é a configuração 1s2 2s2 2p6 3s2 3p3 para o átomo de fósforo, o que significa que a subcamada 1s tem 2 elétrons e assim por diante[1].
O princípio de Aufbau é um diagrama fundamental para o entendimento da estrutura da Tabela Periódica dos Elementos, o qual no Brasil, em muitos livros de química, o modelo é atribuído ao Químico norte-americano Linus Pauling; entretanto, não há evidências de que tenha sido ele o criador desse método. Especificamente, o diagrama é um auxílio mnemônico para descrever a ordem correta com que os elétrons de um átomo preenchem os subníveis da eletrosfera. Ele está baseado na chamada Regra de Madelung, atribuída ao físico alemão Erwin Madelung. Segundo esta regra empírica, os subníveis devem ser preenchidos na ordem crescente de 








A atribuição do diagrama a Linus Pauling é largamente difundida no Brasil, inclusive em livros-texto e em programas para diferentes tipos de concursos públicos e particulares, especialmente na área do ensino médio e vestibulares. Porém, esse nome do diagrama carece completamente de citações internacionais[3]. Uma forma muito mais visualmente complexa do diagrama de fato aparece no célebre livro-texto de química de Pauling, General Chemistry: An Introduction to Descriptive Chemistry and Modern Chemical Theory (1947)[4]. Porém, a versão moderna do diagrama parece ter sido primeiramente apresentada pelo cientista chinês Pao-Fang Yi[5][6] e aperfeiçoada na Austrália pelo professor L. M. Simmons[7]. O professor Therald Moeller[8] em seu livro de Química Inorgânica, descreveu e detalhou a forma do diagrama que conhecemos atualmente. A atribuição a Pauling parece ser assim um caso do chamado Efeito Matthew[9].
Uma justificativa teórica para a validade destas regras, baseada no modelo de Thomas-Fermi, foi apresentada em 1962 pelo químico soviético V. Klechkovsky[10], o qual tem por isso seu nome associado ao diagrama, especialmente em países de língua russa e francesa[11]
Índice
Diagrama
Distribuição eletrônica
| camada | subnível | |
|---|---|---|
| 1 |  |  |
| 2 |  |  e e  |
| 3 |  |  , ,  e e  |
| 4 |  |  , ,  , ,  e e  |
| 5 |  |  , ,  , ,  e e  |
| 6 |  |  , ,  e e  |
| 7 |  |  e e  |
| Nota | ||
 (sharp = nítido), (sharp = nítido),  (principal), (principal),  (diffuse = difuso), (diffuse = difuso),  (fundamental) (fundamental) | ||
Número máximo de elétrons em cada subnível

| subnível | Número de elétrons por subnível |
|---|---|
 |  elétrons elétrons |
 |  elétrons elétrons |
 |  elétrons elétrons |
 |  elétrons elétrons |
O diagrama é representado assim:
| camada | subnível |
|---|---|
 |  |
 |  |
 |  |
 |  |
 |  |
 |  |
 |  |
| Nota | |
 (sharp = nítido), (sharp = nítido),  (principal), (principal), (diffuse = difuso), (diffuse = difuso),  (fundamental) (fundamental) | |
A ordem do diagrama que se lê é: 
Ver também
Na química, valência é um número que indica a capacidade que um átomo de um elemento tem de se combinar com outros átomos, capacidade essa que é medida pelo número de elétrons que um átomo pode dar, receber, ou compartilhar de forma a constituir uma ligação química. Isto está relacionado com o número de espaços omissos nas camadas eletrônicas do átomo. Os adjetivos que descrevem as valências atômicas usam prefixos gregos, como mono, bi, tri e tetra para as valências respectivamente iguais a 1, 2, 3, 4. Grupo dos elementos principais que são os metais geralmente possuem apenas uma valência, igual ao número de elétrons na camada de valência. Metais de transição freqüentemente possuem diversas valências (veja lista abaixo).[1][2]
O termo valência não significa o mesmo que o termo número de oxidação. Para um símples composto iônico o número de oxidação de um metal será geralmente igual ao de valência, embora para compostos covalentes que envolvem não-metais haja frequentemente uma diferença.[3]
Lista
Lista de distribuição eletrônica comuns para os primeiros 103 elementos em ordem de número atômico:
Ver também
Lista dos números de oxidação
Esta é uma lista de todos os números de oxidação conhecidos de todos os elementos químicos. Os estados de oxidação mais comuns estão em negrito. O número de oxidação 0, que existe para todos os elementos, corresponde à coluna com o símbolo do elemento.[1]
| −1 | H | +1 | |||||||||||
| He | |||||||||||||
| −1 | Li | +1 | |||||||||||
| Be | +2 | ||||||||||||
| B | +1 | +2 | +3 | ||||||||||
| −4 | −3 | −2 | −1 | C | +1 | +2 | +3 | +4 | |||||
| −3 | −2 | −1 | N | +1 | +2 | +3 | +4 | +5 | |||||
| −2 | −1 | O | +1 | +2 | |||||||||
| −1 | F | ||||||||||||
| Ne | |||||||||||||
| −1 | Na | +1 | |||||||||||
| Mg | +1 | +2 | |||||||||||
| Al | +1 | +3 | |||||||||||
| −4 | −3 | −2 | −1 | Si | +1 | +2 | +3 | +4 | |||||
| −3 | −2 | −1 | P | +1 | +2 | +3 | +4 | +5 | |||||
| −2 | −1 | S | +1 | +2 | +3 | +4 | +5 | +6 | |||||
| −1 | Cl | +1 | +2 | +3 | +4 | +5 | +6 | +7 | |||||
| Ar | |||||||||||||
| K | +1 | ||||||||||||
| Ca | +2 | ||||||||||||
| Sc | +1 | +2 | +3 | ||||||||||
| −1 | Ti | +2 | +3 | +4 | |||||||||
| −1 | V | +1 | +2 | +3 | +4 | +5 | |||||||
| −2 | −1 | Cr | +1 | +2 | +3 | +4 | +5 | +6 | |||||
| −3 | −2 | −1 | Mn | +1 | +2 | +3 | +4 | +5 | +6 | +7 | |||
| −2 | −1 | Fe | +1 | +2 | +3 | +4 | +5 | +6 | |||||
| −1 | Co | +1 | +2 | +3 | +4 | +5 | |||||||
| −1 | Ni | +1 | +2 | +3 | +4 | ||||||||
| Cu | +1 | +2 | +3 | +4 | |||||||||
| Zn | +2 | ||||||||||||
| Ga | +1 | +2 | +3 | ||||||||||
| −4 | Ge | +1 | +2 | +3 | +4 | ||||||||
| −3 | As | +2 | +3 | +5 | |||||||||
| −2 | Se | +2 | +4 | +6 | |||||||||
| −1 | Br | +1 | +3 | +4 | +5 | +7 | |||||||
| Kr | +2 | ||||||||||||
| Rb | +1 | ||||||||||||
| Sr | +2 | ||||||||||||
| Y | +1 | +2 | +3 | ||||||||||
| Zr | +1 | +2 | +3 | +4 | |||||||||
| −1 | Nb | +2 | +3 | +4 | +5 | ||||||||
| −2 | −1 | Mo | +1 | +2 | +3 | +4 | +5 | +6 | |||||
| −3 | −1 | Tc | +1 | +2 | +3 | +4 | +5 | +6 | +7 | ||||
| −2 | Ru | +1 | +2 | +3 | +4 | +5 | +6 | +7 | +8 | ||||
| −1 | Rh | +1 | +2 | +3 | +4 | +5 | +6 | ||||||
| Pd | +2 | +4 | |||||||||||
| Ag | +1 | +2 | +3 | ||||||||||
| Cd | +2 | ||||||||||||
| In | +1 | +2 | +3 | ||||||||||
| −4 | Sn | +2 | +4 | ||||||||||
| −3 | Sb | +3 | +5 | ||||||||||
| −2 | Te | +2 | +4 | +5 | +6 | ||||||||
| −1 | I | +1 | +3 | +5 | +7 | ||||||||
| Xe | +2 | +4 | +6 | +8 | |||||||||
| Cs | +1 | ||||||||||||
| Ba | +2 | ||||||||||||
| La | +2 | +3 | |||||||||||
| Ce | +2 | +3 | +4 | ||||||||||
| Pr | +2 | +3 | +4 | ||||||||||
| Nd | +2 | +3 | |||||||||||
| Pm | +3 | ||||||||||||
| Sm | +2 | +3 | |||||||||||
| Eu | +2 | +3 | |||||||||||
| Gd | +1 | +2 | +3 | ||||||||||
| Tb | +1 | +3 | +4 | ||||||||||
| Dy | +2 | +3 | |||||||||||
| Ho | +3 | ||||||||||||
| Er | +3 | ||||||||||||
| Tm | +2 | +3 | |||||||||||
| Yb | +2 | +3 | |||||||||||
| Lu | +3 | ||||||||||||
| Hf | +2 | +3 | +4 | ||||||||||
| −1 | Ta | +2 | +3 | +4 | +5 | ||||||||
| −2 | −1 | W | +1 | +2 | +3 | +4 | +5 | +6 | |||||
| −3 | −1 | Re | +1 | +2 | +3 | +4 | +5 | +6 | +7 | ||||
| −2 | Os | +1 | +2 | +3 | +4 | +5 | +6 | +7 | +8 | ||||
| −1 | Ir | +1 | +2 | +3 | +4 | +5 | +6 | ||||||
| Pt | +2 | +4 | +5 | +6 | |||||||||
| −1 | Au | +1 | +2 | +3 | +5 | ||||||||
| Hg | +1 | +2 | +4 | ||||||||||
| Tl | +1 | +3 | |||||||||||
| −4 | Pb | +2 | +4 | ||||||||||
| −3 | Bi | +3 | +5 | ||||||||||
| −2 | Po | +2 | +4 | +6 | |||||||||
| −1 | At | +1 | +3 | +5 | +7 | ||||||||
| Rn | +2 | ||||||||||||
| Fr | +1 | ||||||||||||
| Ra | +2 | ||||||||||||
| Ac | +3 | ||||||||||||
| Th | +2 | +3 | +4 | ||||||||||
| Pa | +3 | +4 | +5 | ||||||||||
| U | +3 | +4 | +5 | +6 | |||||||||
| Np | +3 | +4 | +5 | +6 | +7 | ||||||||
| Pu | +3 | +4 | +5 | +6 | +7 | ||||||||
| Am | +2 | +3 | +4 | +5 | +6 | ||||||||
| Cm | +3 | +4 | |||||||||||
| Bk | +3 | +4 | |||||||||||
| Cf | +2 | +3 | +4 | ||||||||||
| Es | +2 | +3 | |||||||||||
| Fm | +2 | +3 | |||||||||||
| Md | +2 | +3 | |||||||||||
| No | +2 | +3 | |||||||||||
| Lr | +3 | ||||||||||||
| Rf | +4 |
Um desenho com um formato parecido foi usado por Irving Langmuir em 1919 num dos seus estudos sobre a regra do octeto. A periodicidade dos números de oxidação foi uma das particularidades que levaram Langmuir a adotar a regra.[2]
Referências
- ↑ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. pp. 27–28. ISBN 0-080-37941-9
- ↑ Langmuir, Irving (1919). «THE ARRANGEMENT OF ELECTRONS IN ATOMS AND MOLECULES.» (em inglês). J. Am. Chem. Soc. pp. 41 (6), pp 868–
Páginas na categoria "Listas de química"
Esta categoria contém as seguintes 11 páginas (de um total de 11).
Configuração eletrônica dos elementos químicos (página de dados)
Esta página cita fontes, mas estas não cobrem todo o conteúdo. Ajude a inserir referências. Conteúdo não verificável poderá ser removido.—Encontre fontes: Google (notícias, livros e acadêmico) (Novembro de 2020) |
Neste artigo estão tabuladas as configurações eletrônicas dos átomos gasosos neutros em seus estados fundamentais. Para cada átomo, as sub-camadas são fornecidas primeiro de forma concisa, depois com todas as sub-camadas escritas, seguidas pelo número de elétrons por camada. Configurações eletrônicas de elementos além do hássio (elemento 108), incluindo aqueles dos elementos não descobertos além do oganesson (elemento 118), são previstas.
Como regra aproximada, as configurações eletrônicas são dadas pelo princípio de Aufbau e pela regra de Madelung. Existem inúmeras exceções; por exemplo, uma das exceções é o cromo, que deveria ter a configuração 1s2 2s2 2p6 3s2 3p6 3d4 4s2, escrita como [Ar] 3d4 4s2, mas cuja configuração real dada na tabela abaixo é [Ar] 3d5 4s1.
Essas configurações de elétrons são dadas para átomos neutros na fase gasosa, que não são as mesmas que as configurações de elétrons para os mesmos átomos em outros ambientes químicos. Em muitos casos, várias configurações estão dentro de uma pequena faixa de energia e as irregularidades mostradas acima são bastante irrelevantes quimicamente.[1] Para elementos com posição acima de 120, as configurações devem ser consideradas muito provisórias e, em alguns casos, a mistura de configurações é relevante.[2]
Índice
Tabela
| 1 H Hidrogênio : 1s¹ | ||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1s¹ | ||||||||||||||||||
| 1 | ||||||||||||||||||
| 2 He Hélio : 1s² | ||||||||||||||||||
| 1s² | ||||||||||||||||||
| 2 | ||||||||||||||||||
| 3 Li Lítio : 1s² 2s¹ | ||||||||||||||||||
| 1s² | 2s¹ | |||||||||||||||||
| 2 | 1 | |||||||||||||||||
| 4 Be Berílio : 1s² 2s² | ||||||||||||||||||
| 1s² | 2s² | |||||||||||||||||
| 2 | 2 | |||||||||||||||||
| 5 B Boro : 1s² 2s² 2p¹ | ||||||||||||||||||
| 1s² | 2s² | 2p¹ | ||||||||||||||||
| 2 | 3 | |||||||||||||||||
| 6 C Carbono : 1s² 2s² 2p² | ||||||||||||||||||
| 1s² | 2s² | 2p² | ||||||||||||||||
| 2 | 4 | |||||||||||||||||
| 7 N Nitrogênio : 1s² 2s² 2p3 | ||||||||||||||||||
| 1s² | 2s² | 2p3 | ||||||||||||||||
| 2 | 5 | |||||||||||||||||
| 8 O Oxigénio : 1s² 2s² 2p4 | ||||||||||||||||||
| 1s² | 2s² | 2p4 | ||||||||||||||||
| 2 | 6 | |||||||||||||||||
| 9 F Flúor : 1s² 2s² 2p5 | ||||||||||||||||||
| 1s² | 2s² | 2p5 | ||||||||||||||||
| 2 | 7 | |||||||||||||||||
| 10 Ne Néon : 1s² 2s² 2p6 | ||||||||||||||||||
| 1s² | 2s² | 2p6 | ||||||||||||||||
| 2 | 8 | |||||||||||||||||
| 11 Na Sódio : [Ne] 3s¹ | ||||||||||||||||||
| 1s² | 2s² | 2p6 | 3s¹ | |||||||||||||||
| 2 | 8 | 1 | ||||||||||||||||
| 12 Mg Magnésio : [Ne] 3s² | ||||||||||||||||||
| 1s² | 2s² | 2p6 | 3s² | |||||||||||||||
| 2 | 8 | 2 | ||||||||||||||||
| 13 Al Alumínio : [Ne] 3s² 3p¹ | ||||||||||||||||||
| 1s² | 2s² | 2p6 | 3s² | 3p¹ | ||||||||||||||
| 2 | 8 | 3 | ||||||||||||||||
| 14 Si Silício : [Ne] 3s² 3p² | ||||||||||||||||||
| 1s² | 2s² | 2p6 | 3s² | 3p² | ||||||||||||||
| 2 | 8 | 4 | ||||||||||||||||
| 15 P Fósforo : [Ne] 3s² 3p3 | ||||||||||||||||||
| 1s² | 2s² | 2p6 | 3s² | 3p3 | ||||||||||||||
| 2 | 8 | 5 | ||||||||||||||||
| 16 S Enxofre : [Ne] 3s² 3p4 | ||||||||||||||||||
| 1s² | 2s² | 2p6 | 3s² | 3p4 | ||||||||||||||
| 2 | 8 | 6 | ||||||||||||||||
| 17 Cl Cloro : [Ne] 3s² 3p5 | ||||||||||||||||||
| 1s² | 2s² | 2p6 | 3s² | 3p5 | ||||||||||||||
| 2 | 8 | 7 | ||||||||||||||||
| 18 Ar Árgon : [Ne] 3s² 3p6 | ||||||||||||||||||
| 1s² | 2s² | 2p6 | 3s² | 3p6 | ||||||||||||||
| 2 | 8 | 8 | ||||||||||||||||
| 19 K Potássio : [Ar] 4s¹ | ||||||||||||||||||
| 1s² | 2s² | 2p6 | 3s² | 3p6 | 4s¹ | |||||||||||||
| 2 | 8 | 8 | 1 | |||||||||||||||
| 20 Ca Cálcio : [Ar] 4s² | ||||||||||||||||||
| 1s² | 2s² | 2p6 | 3s² | 3p6 | 4s² | |||||||||||||
| 2 | 8 | 8 | 2 | |||||||||||||||
| 21 Sc Escândio : [Ar] 3d¹ 4s² | ||||||||||||||||||
| 1s² | 2s² | 2p6 | 3s² | 3p6 | 3d¹ | 4s² | ||||||||||||
| 2 | 8 | 9 | 2 | |||||||||||||||
| 22 Ti Titânio : [Ar] 3d² 4s² | ||||||||||||||||||
| 1s² | 2s² | 2p6 | 3s² | 3p6 | 3d² | 4s² | ||||||||||||
| 2 | 8 | 10 | 2 | |||||||||||||||
| 23 V Vanádio : [Ar] 3d3 4s² | ||||||||||||||||||
| 1s² | 2s² | 2p6 | 3s² | 3p6 | 3d3 | 4s² | ||||||||||||
| 2 | 8 | 11 | 2 | |||||||||||||||
| 24 Cr Crômio : [Ar] 3d5 4s1 (distribuição eletrónica irregular) | ||||||||||||||||||
| 1s² | 2s² | 2p6 | 3s² | 3p6 | 3d5 | 4s¹ | ||||||||||||
| 2 | 8 | 12 | 1 | |||||||||||||||
| 25 Mn Manganês : [Ar] 3d5 4s² | ||||||||||||||||||
| 1s² | 2s² | 2p6 | 3s² | 3p6 | 3d5 | 4s² | ||||||||||||
| 2 | 8 | 13 | 2 | |||||||||||||||
| 26 Fe Ferro : [Ar] 3d6 4s² | ||||||||||||||||||
| 1s² | 2s² | 2p6 | 3s² | 3p6 | 3d6 | 4s² | ||||||||||||
| 2 | 8 | 14 | 2 | |||||||||||||||
| 27 Co Cobalto : [Ar] 3d7 4s² | ||||||||||||||||||
| 1s² | 2s² | 2p6 | 3s² | 3p6 | 3d7 | 4s² | ||||||||||||
| 2 | 8 | 15 | 2 | |||||||||||||||
| 28 Ni Níquel : [Ar] 3d8 4s² | ||||||||||||||||||
| 1s² | 2s² | 2p6 | 3s² | 3p6 | 3d8 | 4s² | ||||||||||||
| 2 | 8 | 16 | 2 | |||||||||||||||
| 29 Cu Cobre : [Ar] 3d10 4s1 (distribuição eletrónica irregular) | ||||||||||||||||||
| 1s² | 2s² | 2p6 | 3s² | 3p6 | 3d10 | 4s1 | ||||||||||||
| 2 | 8 | 18 | 1 | |||||||||||||||
| 30 Zn Zinco : [Ar] 3d10 4s² | ||||||||||||||||||
| 1s² | 2s² | 2p6 | 3s² | 3p6 | 3d10 | 4s² | ||||||||||||
| 2 | 8 | 18 | 2 | |||||||||||||||
| 31 Ga Gálio : [Ar] 3d10 4s² 4p¹ | ||||||||||||||||||
| 1s² | 2s² | 2p6 | 3s² | 3p6 | 3d10 | 4s² | 4p¹ | |||||||||||
| 2 | 8 | 18 | 3 | |||||||||||||||
| 32 Ge Germânio : [Ar] 3d10 4s² 4p² | ||||||||||||||||||
| 1s² | 2s² | 2p6 | 3s² | 3p6 | 3d10 | 4s² | 4p² | |||||||||||
| 2 | 8 | 18 | 4 | |||||||||||||||
| 33 As Arsénio : [Ar] 3d10 4s² 4p3 | ||||||||||||||||||
| 1s² | 2s² | 2p6 | 3s² | 3p6 | 3d10 | 4s² | 4p3 | |||||||||||
| 2 | 8 | 18 | 5 | |||||||||||||||
| 34 Se Selénio : [Ar] 3d10 4s² 4p4 | ||||||||||||||||||
| 1s² | 2s² | 2p6 | 3s² | 3p6 | 3d10 | 4s² | 4p4 | |||||||||||
| 2 | 8 | 18 | 6 | |||||||||||||||
| 35 Br Bromo : [Ar] 3d10 4s² 4p5 | ||||||||||||||||||
| 1s² | 2s² | 2p6 | 3s² | 3p6 | 3d10 | 4s² | 4p5 | |||||||||||
| 2 | 8 | 18 | 7 | |||||||||||||||
| 36 Kr Crípton : [Ar] 3d10 4s² 4p6 | ||||||||||||||||||
| 1s² | 2s² | 2p6 | 3s² | 3p6 | 3d10 | 4s² | 4p6 | |||||||||||
| 2 | 8 | 18 | 8 | |||||||||||||||
| 37 Rb Rubídio : [Kr] 5s¹ | ||||||||||||||||||
| 1s² | 2s² | 2p6 | 3s² | 3p6 | 3d10 | 4s² | 4p6 | 5s¹ | ||||||||||
| 2 | 8 | 18 | 8 | 1 | ||||||||||||||
| 38 Sr Estrôncio : [Kr] 5s² | ||||||||||||||||||
| 1s² | 2s² | 2p6 | 3s² | 3p6 | 3d10 | 4s² | 4p6 | 5s² | ||||||||||
| 2 | 8 | 18 | 8 | 2 | ||||||||||||||
| 39 Y Ítrio : [Kr] 4d¹ 5s² | ||||||||||||||||||
| 1s² | 2s² | 2p6 | 3s² | 3p6 | 3d10 | 4s² | 4p6 | 4d¹ | 5s² | |||||||||
| 2 | 8 | 18 | 9 | 2 | ||||||||||||||
| 40 Zr Zircónio : [Kr] 4d² 5s² | ||||||||||||||||||
| 1s² | 2s² | 2p6 | 3s² | 3p6 | 3d10 | 4s² | 4p6 | 4d² | 5s² | |||||||||
| 2 | 8 | 18 | 10 | 2 | ||||||||||||||
| 41 Nb Nióbio : [Kr] 4d3 5s² | ||||||||||||||||||
| 1s² | 2s² | 2p6 | 3s² | 3p6 | 3d10 | 4s² | 4p6 | 4d3 | 5s² | |||||||||
| 2 | 8 | 18 | 11 | 2 | ||||||||||||||
| 42 Mo Molibdénio : [Kr] 4d4 5s² | ||||||||||||||||||
| 1s² | 2s² | 2p6 | 3s² | 3p6 | 3d10 | 4s² | 4p6 | 4d4 | 5s² | |||||||||
| 2 | 8 | 18 | 12 | 2 | ||||||||||||||
| 43 Tc Tecnécio : [Kr] 4d5 5s² | ||||||||||||||||||
| 1s² | 2s² | 2p6 | 3s² | 3p6 | 3d10 | 4s² | 4p6 | 4d5 | 5s² | |||||||||
| 2 | 8 | 18 | 13 | 2 | ||||||||||||||
| 44 Ru Ruténio : [Kr] 4d6 5s² | ||||||||||||||||||
| 1s² | 2s² | 2p6 | 3s² | 3p6 | 3d10 | 4s² | 4p6 | 4d6 | 5s² | |||||||||
| 2 | 8 | 18 | 14 | 2 | ||||||||||||||
| 45 Rh Ródio : [Kr] 4d7 5s² | ||||||||||||||||||
| 1s² | 2s² | 2p6 | 3s² | 3p6 | 3d10 | 4s² | 4p6 | 4d7 | 5s² | |||||||||
| 2 | 8 | 18 | 15 | 2 | ||||||||||||||
| 46 Pd Paládio : [Kr] 4d8 5s² | ||||||||||||||||||
| 1s² | 2s² | 2p6 | 3s² | 3p6 | 3d10 | 4s² | 4p6 | 4d8 | 5s² | |||||||||
| 2 | 8 | 18 | 16 | 2 | ||||||||||||||
| 47 Ag Prata : [Kr] 4d9 5s² | ||||||||||||||||||
| 1s² | 2s² | 2p6 | 3s² | 3p6 | 3d10 | 4s² | 4p6 | 4d9 | 5s² | |||||||||
| 2 | 8 | 18 | 17 | 2 | ||||||||||||||
| 48 Cd Cádmio : [Kr] 4d10 5s² | ||||||||||||||||||
| 1s² | 2s² | 2p6 | 3s² | 3p6 | 3d10 | 4s² | 4p6 | 4d10 | 5s2 | |||||||||
| 2 | 8 | 18 | 18 | 2 | ||||||||||||||
| 49 In Índio : [Kr] 4d10 5s² 5p¹ | ||||||||||||||||||
| 1s² | 2s² | 2p6 | 3s² | 3p6 | 3d10 | 4s² | 4p6 | 4d10 | 5s² | 5p¹ | ||||||||
| 2 | 8 | 18 | 18 | 3 | ||||||||||||||
| 50 Sn Estanho : [Kr] 4d10 5s² 5p² | ||||||||||||||||||
| 1s² | 2s² | 2p6 | 3s² | 3p6 | 3d10 | 4s² | 4p6 | 4d10 | 5s² | 5p² | ||||||||
| 2 | 8 | 18 | 18 | 4 | ||||||||||||||
| 51 Sb Antimónio : [Kr] 4d10 5s² 5p3 | ||||||||||||||||||
| 1s² | 2s² | 2p6 | 3s² | 3p6 | 3d10 | 4s² | 4p6 | 4d10 | 5s² | 5p3 | ||||||||
| 2 | 8 | 18 | 18 | 5 | ||||||||||||||
| 52 Te Telúrio : [Kr] 4d10 5s² 5p4 | ||||||||||||||||||
| 1s² | 2s² | 2p6 | 3s² | 3p6 | 3d10 | 4s² | 4p6 | 4d10 | 5s² | 5p4 | ||||||||
| 2 | 8 | 18 | 18 | 6 | ||||||||||||||
| 53 I Iodo : [Kr] 4d10 5s² 5p5 | ||||||||||||||||||
| 1s² | 2s² | 2p6 | 3s² | 3p6 | 3d10 | 4s² | 4p6 | 4d10 | 5s² | 5p5 | ||||||||
| 2 | 8 | 18 | 18 | 7 | ||||||||||||||
| 54 Xe Xénon : [Kr] 4d10 5s² 5p6 | ||||||||||||||||||
| 1s² | 2s² | 2p6 | 3s² | 3p6 | 3d10 | 4s² | 4p6 | 4d10 | 5s² | 5p6 | ||||||||
| 2 | 8 | 18 | 18 | 8 | ||||||||||||||
| 55 Cs Césio : [Xe] 6s¹ | ||||||||||||||||||
| 1s² | 2s² | 2p6 | 3s² | 3p6 | 3d10 | 4s² | 4p6 | 4d10 | 5s² | 5p6 | 6s¹ | |||||||
| 2 | 8 | 18 | 18 | 8 | 1 | |||||||||||||
| 56 Ba Bário : [Xe] 6s² | ||||||||||||||||||
| 1s² | 2s² | 2p6 | 3s² | 3p6 | 3d10 | 4s² | 4p6 | 4d10 | 5s² | 5p6 | 6s² | |||||||
| 2 | 8 | 18 | 18 | 8 | 2 | |||||||||||||
| 57 La Lantânio : [Xe] 4f¹ 6s² | ||||||||||||||||||
| 1s² | 2s² | 2p6 | 3s² | 3p6 | 3d10 | 4s² | 4p6 | 4d10 | 4f¹ | 5s² | 5p6 | 6s² | ||||||
| 2 | 8 | 18 | 19 | 8 | 2 | |||||||||||||
| 58 Ce Cério : [Xe] 4f² 6s² | ||||||||||||||||||
| 1s² | 2s² | 2p6 | 3s² | 3p6 | 3d10 | 4s² | 4p6 | 4d10 | 4f² | 5s² | 5p6 | 6s² | ||||||
| 2 | 8 | 18 | 20 | 8 | 2 | |||||||||||||
| 59 Pr Praseodímio : [Xe] 4f3 6s² | ||||||||||||||||||
| 1s² | 2s² | 2p6 | 3s² | 3p6 | 3d10 | 4s² | 4p6 | 4d10 | 4f3 | 5s² | 5p6 | 6s² | ||||||
| 2 | 8 | 18 | 21 | 8 | 2 | |||||||||||||
| 60 Nd Neodímio : [Xe] 4f4 6s² | ||||||||||||||||||
| 1s² | 2s² | 2p6 | 3s² | 3p6 | 3d10 | 4s² | 4p6 | 4d10 | 4f4 | 5s² | 5p6 | 6s² | ||||||
| 2 | 8 | 18 | 22 | 8 | 2 | |||||||||||||
| 61 Pm Promécio : [Xe] 4f5 6s² | ||||||||||||||||||
| 1s² | 2s² | 2p6 | 3s² | 3p6 | 3d10 | 4s² | 4p6 | 4d10 | 4f5 | 5s² | 5p6 | 6s² | ||||||
| 2 | 8 | 18 | 23 | 8 | 2 | |||||||||||||
| 62 Sm Samário : [Xe] 4f6 6s² | ||||||||||||||||||
| 1s² | 2s² | 2p6 | 3s² | 3p6 | 3d10 | 4s² | 4p6 | 4d10 | 4f6 | 5s² | 5p6 | 6s² | ||||||
| 2 | 8 | 18 | 24 | 8 | 2 | |||||||||||||
| 63 Eu Európio : [Xe] 4f7 6s² | ||||||||||||||||||
| 1s² | 2s² | 2p6 | 3s² | 3p6 | 3d10 | 4s² | 4p6 | 4d10 | 4f7 | 5s² | 5p6 | 6s² | ||||||
| 2 | 8 | 18 | 25 | 8 | 2 | |||||||||||||
| 64 Gd Gadolínio : [Xe] 4f7 5d1 6s² (distribuição eletrónica irregular) | ||||||||||||||||||
| 1s² | 2s² | 2p6 | 3s² | 3p6 | 3d10 | 4s² | 4p6 | 4d10 | 4f7 | 5s² | 5p6 | 6s² | ||||||
| 2 | 8 | 18 | 26 | 8 | 2 | |||||||||||||
| 65 Tb Térbio : [Xe] 4f9 6s² | ||||||||||||||||||
| 1s² | 2s² | 2p6 | 3s² | 3p6 | 3d10 | 4s² | 4p6 | 4d10 | 4f9 | 5s² | 5p6 | 6s² | ||||||
| 2 | 8 | 18 | 27 | 8 | 2 | |||||||||||||
| 66 Dy Disprósio : [Xe] 4f10 6s² | ||||||||||||||||||
| 1s² | 2s² | 2p6 | 3s² | 3p6 | 3d10 | 4s² | 4p6 | 4d10 | 4f10 | 5s² | 5p6 | 6s² | ||||||
| 2 | 8 | 18 | 28 | 8 | 2 | |||||||||||||
| 67 Ho Hólmio : [Xe] 4f11 6s² | ||||||||||||||||||
| 1s² | 2s² | 2p6 | 3s² | 3p6 | 3d10 | 4s² | 4p6 | 4d10 | 4f11 | 5s² | 5p6 | 6s² | ||||||
| 2 | 8 | 18 | 29 | 8 | 2 | |||||||||||||
| 68 Er Érbio : [Xe] 4f12 6s² | ||||||||||||||||||
| 1s² | 2s² | 2p6 | 3s² | 3p6 | 3d10 | 4s² | 4p6 | 4d10 | 4f12 | 5s² | 5p6 | 6s² | ||||||
| 2 | 8 | 18 | 30 | 8 | 2 | |||||||||||||
| 69 Tm Túlio : [Xe] 4f13 6s² | ||||||||||||||||||
| 1s² | 2s² | 2p6 | 3s² | 3p6 | 3d10 | 4s² | 4p6 | 4d10 | 4f13 | 5s² | 5p6 | 6s² | ||||||
| 2 | 8 | 18 | 31 | 8 | 2 | |||||||||||||
| 70 Yb Itérbio : [Xe] 4f14 6s² | ||||||||||||||||||
| 1s² | 2s² | 2p6 | 3s² | 3p6 | 3d10 | 4s² | 4p6 | 4d10 | 4f14 | 5s² | 5p6 | 6s² | ||||||
| 2 | 8 | 18 | 32 | 8 | 2 | |||||||||||||
| 71 Lu Lutécio : [Xe] 4f14 5d¹ 6s² | ||||||||||||||||||
| 1s² | 2s² | 2p6 | 3s² | 3p6 | 3d10 | 4s² | 4p6 | 4d10 | 4f14 | 5s² | 5p6 | 5d¹ | 6s² | |||||
| 2 | 8 | 18 | 32 | 9 | 2 | |||||||||||||
| 72 Hf Háfnio : [Xe] 4f14 5d² 6s² | ||||||||||||||||||
| 1s² | 2s² | 2p6 | 3s² | 3p6 | 3d10 | 4s² | 4p6 | 4d10 | 4f14 | 5s² | 5p6 | 5d² | 6s² | |||||
| 2 | 8 | 18 | 32 | 10 | 2 | |||||||||||||
| 73 Ta Tântalo : [Xe] 4f14 5d3 6s² | ||||||||||||||||||
| 1s² | 2s² | 2p6 | 3s² | 3p6 | 3d10 | 4s² | 4p6 | 4d10 | 4f14 | 5s² | 5p6 | 5d3 | 6s² | |||||
| 2 | 8 | 18 | 32 | 11 | 2 | |||||||||||||
| 74 W Tungstênio : [Xe] 4f14 5d4 6s² | ||||||||||||||||||
| 1s² | 2s² | 2p6 | 3s² | 3p6 | 3d10 | 4s² | 4p6 | 4d10 | 4f14 | 5s² | 5p6 | 5d4 | 6s² | |||||
| 2 | 8 | 18 | 32 | 12 | 2 | |||||||||||||
| 75 Re Rênio : [Xe] 4f14 5d5 6s² | ||||||||||||||||||
| 1s² | 2s² | 2p6 | 3s² | 3p6 | 3d10 | 4s² | 4p6 | 4d10 | 4f14 | 5s² | 5p6 | 5d5 | 6s² | |||||
| 2 | 8 | 18 | 32 | 13 | 2 | |||||||||||||
| 76 Os Ósmio : [Xe] 4f14 5d6 6s² | ||||||||||||||||||
| 1s² | 2s² | 2p6 | 3s² | 3p6 | 3d10 | 4s² | 4p6 | 4d10 | 4f14 | 5s² | 5p6 | 5d6 | 6s² | |||||
| 2 | 8 | 18 | 32 | 14 | 2 | |||||||||||||
| 77 Ir Irídio : [Xe] 4f14 5d7 6s² | ||||||||||||||||||
| 1s² | 2s² | 2p6 | 3s² | 3p6 | 3d10 | 4s² | 4p6 | 4d10 | 4f14 | 5s² | 5p6 | 5d7 | 6s² | |||||
| 2 | 8 | 18 | 32 | 15 | 2 | |||||||||||||
| 78 Pt Platina : [Xe] 4f14 5d8 6s² | ||||||||||||||||||
| 1s² | 2s² | 2p6 | 3s² | 3p6 | 3d10 | 4s² | 4p6 | 4d10 | 4f14 | 5s² | 5p6 | 5d8 | 6s² | |||||
| 2 | 8 | 18 | 32 | 16 | 2 | |||||||||||||
| 79 Au Ouro : [Xe] 4f14 5d10 6s¹ | ||||||||||||||||||
| 1s² | 2s² | 2p6 | 3s² | 3p6 | 3d10 | 4s² | 4p6 | 4d10 | 4f14 | 5s² | 5p6 | 5d9 | 6s¹ | |||||
| 2 | 8 | 18 | 32 | 17 | 1 | |||||||||||||
| 80 Hg Mercúrio : [Xe] 4f14 5d10 6s² | ||||||||||||||||||
| 1s² | 2s² | 2p6 | 3s² | 3p6 | 3d10 | 4s² | 4p6 | 4d10 | 4f14 | 5s² | 5p6 | 5d10 | 6s² | |||||
| 2 | 8 | 18 | 32 | 18 | 2 | |||||||||||||
| 81 Tl Tálio : [Xe] 4f14 5d10 6s² 6p¹ | ||||||||||||||||||
| 1s² | 2s² | 2p6 | 3s² | 3p6 | 3d10 | 4s² | 4p6 | 4d10 | 4f14 | 5s² | 5p6 | 5d10 | 6s² | 6p¹ | ||||
| 2 | 8 | 18 | 32 | 18 | 3 | |||||||||||||
| 82 Pb Chumbo : [Xe] 4f14 5d10 6s² 6p² | ||||||||||||||||||
| 1s² | 2s² | 2p6 | 3s² | 3p6 | 3d10 | 4s² | 4p6 | 4d10 | 4f14 | 5s² | 5p6 | 5d10 | 6s² | 6p² | ||||
| 2 | 8 | 18 | 32 | 18 | 4 | |||||||||||||
| 83 Bi Bismuto : [Xe] 4f14 5d10 6s² 6p3 | ||||||||||||||||||
| 1s² | 2s² | 2p6 | 3s² | 3p6 | 3d10 | 4s² | 4p6 | 4d10 | 4f14 | 5s² | 5p6 | 5d10 | 6s² | 6p3 | ||||
| 2 | 8 | 18 | 32 | 18 | 5 | |||||||||||||
| 84 Po Polônio : [Xe] 4f14 5d10 6s² 6p4 | ||||||||||||||||||
| 1s² | 2s² | 2p6 | 3s² | 3p6 | 3d10 | 4s² | 4p6 | 4d10 | 4f14 | 5s² | 5p6 | 5d10 | 6s² | 6p4 | ||||
| 2 | 8 | 18 | 32 | 18 | 6 | |||||||||||||
| 85 At Astato : [Xe] 4f14 5d10 6s² 6p5 | ||||||||||||||||||
| 1s² | 2s² | 2p6 | 3s² | 3p6 | 3d10 | 4s² | 4p6 | 4d10 | 4f14 | 5s² | 5p6 | 5d10 | 6s² | 6p5 | ||||
| 2 | 8 | 18 | 32 | 18 | 7 | |||||||||||||
| 86 Rn Radônio : [Xe] 4f14 5d10 6s² 6p6 | ||||||||||||||||||
| 1s² | 2s² | 2p6 | 3s² | 3p6 | 3d10 | 4s² | 4p6 | 4d10 | 4f14 | 5s² | 5p6 | 5d10 | 6s² | 6p6 | ||||
| 2 | 8 | 18 | 32 | 18 | 8 | |||||||||||||
| 87 Fr Frâncio : [Rn] 7s¹ | ||||||||||||||||||
| 1s² | 2s² | 2p6 | 3s² | 3p6 | 3d10 | 4s² | 4p6 | 4d10 | 4f14 | 5s² | 5p6 | 5d10 | 6s² | 6p6 | 7s¹ | |||
| 2 | 8 | 18 | 32 | 18 | 8 | 1 | ||||||||||||
| 88 Ra Rádio : [Rn] 7s² | ||||||||||||||||||
| 1s² | 2s² | 2p6 | 3s² | 3p6 | 3d10 | 4s² | 4p6 | 4d10 | 4f14 | 5s² | 5p6 | 5d10 | 6s² | 6p6 | 7s² | |||
| 2 | 8 | 18 | 32 | 18 | 8 | 2 | ||||||||||||
| 89 Ac Actínio : [Rn] 5f¹ 7s² | ||||||||||||||||||
| 1s² | 2s² | 2p6 | 3s² | 3p6 | 3d10 | 4s² | 4p6 | 4d10 | 4f14 | 5s² | 5p6 | 5d10 | 5f¹ | 6s² | 6p6 | 7s² | ||
| 2 | 8 | 18 | 32 | 19 | 8 | 2 | ||||||||||||
| 90 Th Tório : [Rn] 5f² 7s² | ||||||||||||||||||
| 1s² | 2s² | 2p6 | 3s² | 3p6 | 3d10 | 4s² | 4p6 | 4d10 | 4f14 | 5s² | 5p6 | 5d10 | 5f² | 6s² | 6p6 | 7s² | ||
| 2 | 8 | 18 | 32 | 20 | 8 | 2 | ||||||||||||
| 91 Pa Protactínio : [Rn] 5f3 7s² | ||||||||||||||||||
| 1s² | 2s² | 2p6 | 3s² | 3p6 | 3d10 | 4s² | 4p6 | 4d10 | 4f14 | 5s² | 5p6 | 5d10 | 5f3 | 6s² | 6p6 | 7s² | ||
| 2 | 8 | 18 | 32 | 21 | 8 | 2 | ||||||||||||
| 92 U Urânio : [Rn] 5f4 7s² | ||||||||||||||||||
| 1s² | 2s² | 2p6 | 3s² | 3p6 | 3d10 | 4s² | 4p6 | 4d10 | 4f14 | 5s² | 5p6 | 5d10 | 5f4 | 6s² | 6p6 | gulag | 7s² | |
| 2 | 8 | 18 | 32 | 22 | 8 | 2 | ||||||||||||
| 93 Np Neptúnio : [Rn] 5f5 7s² | ||||||||||||||||||
| 1s² | 2s² | 2p6 | 3s² | 3p6 | 3d10 | 4s² | 4p6 | 4d10 | 4f14 | 5s² | 5p6 | 5d10 | 5f5 | 6s² | 6p6 | 7s² | ||
| 2 | 8 | 18 | 32 | 23 | 8 | 2 | ||||||||||||
| 94 Pu Plutônio : [Rn] 5f6 7s² | ||||||||||||||||||
| 1s² | 2s² | 2p6 | 3s² | 3p6 | 3d10 | 4s² | 4p6 | 4d10 | 4f14 | 5s² | 5p6 | 5d10 | 5f6 | 6s² | 6p6 | 7s² | ||
| 2 | 8 | 18 | 32 | 24 | 8 | 2 | ||||||||||||
| 95 Am Amerício : [Rn] 5f7 7s² | ||||||||||||||||||
| 1s² | 2s² | 2p6 | 3s² | 3p6 | 3d10 | 4s² | 4p6 | 4d10 | 4f14 | 5s² | 5p6 | 5d10 | 5f7 | 6s² | 6p6 | 7s² | ||
| 2 | 8 | 18 | 32 | 25 | 8 | 2 | ||||||||||||
| 96 Cm Cúrio : [Rn] 5f8 7s² | ||||||||||||||||||
| 1s² | 2s² | 2p6 | 3s² | 3p6 | 3d10 | 4s² | 4p6 | 4d10 | 4f14 | 5s² | 5p6 | 5d10 | 5f8 | 6s² | 6p6 | 7s² | ||
| 2 | 8 | 18 | 32 | 26 | 8 | 2 | ||||||||||||
| 97 Bk Berquélio : [Rn] 5f9 7s² | ||||||||||||||||||
| 1s² | 2s² | 2p6 | 3s² | 3p6 | 3d10 | 4s² | 4p6 | 4d10 | 4f14 | 5s² | 5p6 | 5d10 | 5f9 | 6s² | 6p6 | 7s² | ||
| 2 | 8 | 18 | 32 | 27 | 8 | 2 | ||||||||||||
| 98 Cf Califórnio : [Rn] 5f10 7s² | ||||||||||||||||||
| 1s² | 2s² | 2p6 | 3s² | 3p6 | 3d10 | 4s² | 4p6 | 4d10 | 4f14 | 5s² | 5p6 | 5d10 | 5f10 | 6s² | 6p6 | 7s² | ||
| 2 | 8 | 18 | 32 | 28 | 8 | 2 | ||||||||||||
| 99 Es Einstênio : [Rn] 5f11 7s² | ||||||||||||||||||
| 1s² | 2s² | 2p6 | 3s² | 3p6 | 3d10 | 4s² | 4p6 | 4d10 | 4f14 | 5s² | 5p6 | 5d10 | 5f11 | 6s² | 6p6 | 7s² | ||
| 2 | 8 | 18 | 32 | 29 | 8 | 2 | ||||||||||||
| 100 Fm Férmio : [Rn] 5f12 7s² | ||||||||||||||||||
| 1s² | 2s² | 2p6 | 3s² | 3p6 | 3d10 | 4s² | 4p6 | 4d10 | 4f14 | 5s² | 5p6 | 5d10 | 5f12 | 6s² | 6p6 | 7s² | ||
| 2 | 8 | 18 | 32 | 30 | 8 | 2 | ||||||||||||
| 101 Md Mendelévio : [Rn] 5f13 7s² | ||||||||||||||||||
| 1s² | 2s² | 2p6 | 3s² | 3p6 | 3d10 | 4s² | 4p6 | 4d10 | 4f14 | 5s² | 5p6 | 5d10 | 5f13 | 6s² | 6p6 | 7s² | ||
| 2 | 8 | 18 | 32 | 31 | 8 | 2 | ||||||||||||
| 102 No Nobélio : [Rn] 5f14 7s² | ||||||||||||||||||
| 1s² | 2s² | 2p6 | 3s² | 3p6 | 3d10 | 4s² | 4p6 | 4d10 | 4f14 | 5s² | 5p6 | 5d10 | 5f14 | 6s² | 6p6 | 7s² | ||
| 2 | 8 | 18 | 32 | 32 | 8 | 2 | ||||||||||||
| 103 Lr Laurêncio : probably [Rn] 5f14 7s² 6d¹ | ||||||||||||||||||
| 1s² | 2s² | 2p6 | 3s² | 3p6 | 3d10 | 4s² | 4p6 | 4d10 | 4f14 | 5s² | 5p6 | 5d10 | 5f14 | 6s² | 6p6 | 6d¹ | 7s² | |
| 2 | 8 | 18 | 32 | 32 | 9 | 2 | ||||||||||||
| 104 Rf Rutherfórdio : probably [Rn] 5f14 6d² 7s² | ||||||||||||||||||
| 1s² | 2s² | 2p6 | 3s² | 3p6 | 3d10 | 4s² | 4p6 | 4d10 | 4f14 | 5s² | 5p6 | 5d10 | 5f14 | 6s² | 6p6 | 6d² | 7s² | |
| 2 | 8 | 18 | 32 | 32 | 10 | 2 | ||||||||||||
Bibliografia
NIST (Instituto Nacional de Padrões e Tecnologia)
- Ground Levels and Ionization Energies for the Neutral Atoms - NIST Standard Reference Database 111 ; acessado em 7 de novembro de 2020, (elementos 1–104) baseado no:
- Atomic Spectroscopy, por W.C. Martin and W.L. Wiese em Atomic, Molecular, & Optical Physics Handbook, ed. por G.W.F. Drake (AIP, Woodbury, NY, 1996) Chapter 10, pp. 135-153.
Este site também é citado no Manual do CRC como fonte da Seção 1, subseção Configuração de elétrons de átomos neutros no estado fundamental.
- 91 Pa : [Rn] 5f²(3H4) 6d 7s²
- 92 U : [Rn] 5f3(4Io9/2) 6d 7s²
- 93 Np : [Rn] 5f4(5I4) 6d 7s²
- 103 Lr : [Rn] 5f14 7s² 7p¹ question-marked
- 104 Rf : [Rn] 5f14 6d² 7s² question-marked
CRC
- David R. Lide (ed), CRC Handbook of Chemistry and Physics, 84th Edition, versão online. CRC Press. Boca Raton, Florida, 2003; Section 1, Basic Constants, Units, and Conversion Factors; Electron Configuration of Neutral Atoms in the Ground State. (elementos 1–104)
- Também subseção Tabela Periódica dos Elementos, (elementos 1–103) baseado em:
- G. J. Leigh, Editor, Nomenclature of Inorganic Chemistry, Blackwell Scientific Publications, Oxford, 1990.
- Chemical and Engineering News, 63(5), 27, 1985.
- Atomic Weights of the Elements, 1999, Pure & Appl. Chem., 73, 667, 2001.
- 934. doi:10.1021/ja02227a002
| [Esconder] | |
|---|---|
- Gerar link
- X
- Outros aplicativos







Comentários
Postar um comentário